Contenidos
| James Prescott Joule | ||
|---|---|---|
 James Prescott Joule. | ||
| Información personal | ||
| Nacimiento |
24 de diciembre de 1818 Salford (Reino Unido de Gran Bretaña e Irlanda) | |
| Fallecimiento |
11 de octubre de 1889 (70 años) Sale (Reino Unido) | |
| Sepultura | Brooklands | |
| Nacionalidad | Británico | |
| Familia | ||
| Padres |
Benjamin Joule Alice Prescott | |
| Cónyuge | Amelia Grimes | |
| Educación | ||
| Educado en | Universidad de Mánchester | |
| Alumno de | John Dalton | |
| Información profesional | ||
| Ocupación | Físico | |
| Área | Químico y física | |
| Cargos ocupados |
| |
| Obras notables | termodinámica | |
| Miembro de |
| |
| Distinciones |
| |
James Prescott Joule (Salford, Reino Unido, 24 de diciembre de 1818-11 de octubre de 1889) fue un físico inglés, uno de los más notables físicos de su época, conocido sobre todo por sus investigaciones en termodinámica. Descubrió su relación con el trabajo mecánico, lo cual le condujo a la teoría de la energía. La unidad internacional de energía, calor y trabajo, el joule, fue bautizada en su honor. Trabajó con lord Kelvin para desarrollar la escala absoluta de la temperatura, hizo observaciones sobre la teoría termodinámica (efecto Joule-Thomson) y encontró una relación entre la corriente eléctrica que atraviesa una resistencia y el calor disipado, llamada actualmente ley de Joule. Después de numerosos experimentos, obtuvo el valor numérico del equivalente mecánico del calor. Contribuyó a explicar la teoría cinética de los gases. Fue «posiblemente el último autodidacta que hizo una contribución significativa al progreso de la ciencia».[1]
Biografía
James Prescott Joule era hijo de Benjamin Joule (1784-1858), propietario de una fábrica de cerveza. De carácter tímido y humilde, recibió clases particulares en su propio hogar de física y matemáticas, siendo su profesor el químico británico John Dalton; compaginaba estas clases con su actividad profesional, trabajando junto a su padre en la destilería, la cual llegó a dirigir. Dalton le alentó hacia la investigación científica y realizó sus primeros experimentos en un laboratorio cercano a la fábrica de cervezas, formándose a la vez en la Universidad de Mánchester.[2] Solo recibió dos años de educación en aritmética y geometría antes de que Dalton se tuviera que retirar por un accidente vascular cerebral. Aun así, Dalton influyó en Joule, así como sus socios, el químico William Henry y los ingenieros de Mánchester Peter Ewart y Eaton Hodgkinson. Más adelante, Joule fue educado por John Davies. Joule estaba fascinado por la electricidad. Él y su hermano experimentaban dándose descargas eléctricas el uno al otro y también a los criados de la familia.[3]
Joule llegó a gerente de la cervecería y tuvo un papel activo hasta que el negocio fue vendido en 1854. La ciencia era una afición, pero pronto empezó a investigar la posibilidad de sustituir la máquina de vapor de la cervecería con un motor eléctrico, entonces recién inventado. Joule tenía una habitación en casa de su padre que la utilizaba como laboratorio; fue allí donde empezó a hacer sus primeros experimentos eléctricos y magnéticos.[4] En 1838 contribuyó con sus primeros trabajos académicos sobre electricidad en los Annals of Electricity, la revista científica fundada y dirigida por el socio de Davies William Sturgeon. Descubrió la ley de Joule en 1840[5] e intentó impresionar a la Royal Society pero descubrió, no por última vez, que se le veía como un mero principiante de provincias. Cuando Sturgeon se mudó a Mánchester en 1840, Joule y él llegaron a ser el centro de un círculo de intelectuales de la ciudad. Ambos compartían la creencia de que la ciencia y la teología tenían que integrarse. Joule enseñó en la Royal Victoria Gallery of Practical Science de Sturgeon.[3]
Descubrió que quemar una libra de carbón en una máquina de vapor produce cinco veces el trabajo del consumo de una libra de zinc en una Celda de Grove,[nota 1] una de las primeras baterías eléctricas.[6] La unidad estándar de trabajo de Joule era la capacidad de levantar una libra a una altura de un pie, el pie-libra.[nota 2][3]
Joule fue influido por el pensamiento de Franz Aepinus y trató de explicar los fenómenos de la electricidad y el magnetismo en términos de átomos rodeados por un "éter calorífico en estado de vibración".[3]
Aun así, el interés de Joule cambió desde algo puramente financiero sobre cuánto trabajo se podía extraer de una única fuente, hasta especular sobre la transformación de la energía. En 1843 publicó los resultados de sus experimentos, que demostraban que el efecto de calentamiento que había cuantificado en 1841 se debía a la generación de calor en el conductor eléctrico y no a su transmisión desde otra parte del equipamiento.[7] Esto era un reto directo de la teoría del calórico, que sostenía que el calor no se podía ni crear ni destruir. La teoría del calórico había dominado el pensamiento en la ciencia del calor desde que Antoine Lavoisier lo había introducido en 1783. El prestigio de Lavoisier y el éxito práctico de la teoría del calórico de la máquina de vapor de Sadi Carnot desde 1824 hicieron que el joven Joule, que trabajaba fuera de los ámbitos académico y de ingeniería, tuviera un camino difícil para recorrer. Los valedores de la teoría del calórico indicaron la simetría de la efecto Peltier-Seebeck para afirmar que el calor y la corriente son convertibles, al menos aproximadamente, por un proceso reversible.[3]
En junio de 1844, su padre se trasladó de Pendlebury a Whalley Range e hizo construir un laboratorio para su hijo situado cerca de la casa.[4] Joule mantuvo una estrecha relación con la Manchester Literary and Philosophical Society. El 25 de enero de 1842 acabó siendo miembro de la sociedad, en 1844 era nombrado bibliotecario, en 1846 secretario honorario, en 1851 vicepresidente y finalmente, en 1860 llegó a presidente de la sociedad por primera vez.[4]
El equivalente mecánico del calor
En su obra del 1845, Joule escribió:
... el trabajo mecánico ejercido al girar una máquina magnetoeléctrica se convierte en calor creado por el paso de corrientes inductivas a través de sus bobinas; y, por otro lado, que el poder motil del motor magnetoeléctrico se obtiene a expensas del calor debido a las reacciones químicas de la batería que lo hace trabajar.[8]

En este pasaje, Joule adopta el lenguaje de la vis viva (energía), posiblemente porque Hodgkinson había leído una revisión de la obra de Ewart On the measure of moving force a la Literary and Philosophical Society en abril del 1844.
Experimentos y medidas posteriores hechos por Joule le llevaron a calcular que el equivalente mecánico del calor era de 838 pies-libra para elevar la temperatura de una libra de agua en un grado Fahrenheit.[9] Anunció sus resultados en un encuentro del departamento de química de la British Association for the Advancement of Science en Cork en 1843, pero se encontró con un silencio como respuesta.
Joule no se desanimó y empezó a buscar una demostración puramente mecánica de la conversión de trabajo en calor. Forzando agua a través de un cilindro perforado, fue capaz de medir el ligero calentamiento viscoso del fluido. Obtuvo un equivalente mecánico de 770 pies-libra/UTB (4,14 J/cal). El hecho de que los valores obtenidos tanto por medios eléctricos y puramente mecánicos se correspondieran al menos un orden de magnitud era, para Joule, evidencia convincente de la realidad de la transformación de trabajo en calor.
Joule probó un tercer camino. Midió el calor generado con el trabajo hecho al comprimir un gas. Obtuvo un equivalente mecánico de 823 pies-libra (4,43 J/cal).[10] De muchas maneras, este experimento se convirtió en el objetivo más fácil para los críticos de Joule, pero Joule se encargó de las objeciones anticipadas mediante experimentos inteligentes. Aun así, su obra fue rehusada por la Royal Society y se tuvo que contentar con publicarla en la Philosophical Magazine. En esta obra quedaba evidente su rechazo del razonamiento calórico de Carnot y Émile Clapeyron, pero también eran evidentes sus motivaciones teológicas:
Concibo que esta teoría... se opone a los principios reconocidos de la filosofía porque lleva a la conclusión que la vis viva se puede destruir mediante una configuración incorrecta del aparato: por lo tanto, el Sr. Clapeyron infiere que «siendo la temperatura del fuego entre 1000 °C y 2000 °C superior a la de la caldera, hay una enorme pérdida de vis viva en el paso del calor del horno a la caldera». Convencido de que el poder de destruir cosas pertenece únicamente al Creador, afirmo... que cualquier teoría que, cuando puesta en práctica, requiere la aniquilación de fuerza, es necesariamente errónea.
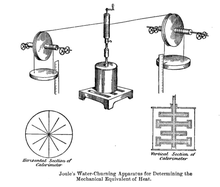

En 1845, Joule leyó su obra On the mechanical equivalient of heat en la reunión de la British Association en Cambridge.[11] En esta obra, explicó su experimento más conocido, utilizando un peso cayendo para hacer girar un carrete en un barril de agua aislado, del cual midió el incremento de temperatura. Su nueva estimación del equivalente mecánico era de 819 pies-libra/BTU (4.41 J/cal).
En 1850, Joule publicó una medida refinada de 772,692 pies-libra/BTU (4,159 J/cal), más cercana a las estimaciones del siglo XX.[12]
Recepción y prioridad
Gran parte de la resistencia inicial de la obra de Joule se debía a su dependencia de medidas extremamente precisas. Afirmaba poder medir temperaturas con un margen de error de sólo 1/200 de grado Fahrenheit. Una precisión de esta magnitud era ciertamente rara en la física experimental de su tiempo, pero sus críticos podrían haber despreciado su experiencia en el arte de la cervecería y en su acceso a tecnologías prácticas.[13] También recibió el apoyo del fabricante de instrumentos científicos John Benjamin Dancer.[14]
Aun así, el alemán Hermann Helmholtz descubrió la obra de Joule y una obra similar publicada en 1842 por Julius Robert von Mayer. A pesar de que ambos habían sido despreciados desde la publicación de sus respectivos trabajos, la declaración definitiva del 1847 de Helmholtz de la conservación de la energía dio crédito a los dos.
También en 1847, en una de las exposiciones de Joule de la British Association en Oxford asistieron George Gabriel Stokes, Michael Faraday, y el precoz e independiente William Thomson, quien más tarde sería nombrado Lord Kelvin, y que acababa de conseguir el puesto de catedrático de filosofía natural de la Universidad de Glasgow. Stokes se sintió «inclinado a ser un Joulita» y Faraday «quedó muy impresionado», a pesar de que tenía dudas. Thomson estaba intrigado pero permanecía escéptico.
Thomson y Joule se encontraron de imprevisto más tarde aquel año en Chamonix. Joule se casó con Amelia Grimes el 18 de agosto y la pareja marchó de luna de miel. Dejando de lado el entusiasmo marital, Joule y Thomson decidieron intentar un experimento unos días más tarde para medir la diferencia de temperatura entre la parte superior y la parte inferior de la Cascada de Sallanches, a pesar de que más tarde esto se reveló muy poco práctico.
A pesar de que Thomson sentía que los resultados de Joule exigían una explicación teórica, defendió con vigor la escuela de Carnot y Clapeyron. En su tratado sobre la temperatura absoluta de 1848, Thomson escribió que «la conversión de calor (o calórico) en efecto mecánico es probablemente imposible, y ciertamente no ha sido descubierta»[15] - pero una nota a pie de página demostró sus dudas sobre la teoría calórica, refiriéndose a los «descubrimientos muy remarcables» de Joule. Sorprendentemente, Thomson no envió a Joule una copia de la obra, pero cuando este finalmente la leyó, escribió a Thomson el 6 de octubre, afirmando que sus estudios habían demostrado la conversión de calor en trabajo pero que estaba planeando más experimentos. Thomson respondió el día 27, revelando que estaba planeando sus propios experimentos y que esperaba una reconciliación de sus dos teorías. A pesar de que Thomson no hizo más experimentos, a lo largo de los dos años siguientes se desencantó con la teoría de Carnot y se convenció de la de Joule. En su obra de 1852, Thomson no deseaba llegar más lejos que un compromiso y declaró que «toda la teoría del poder motil del calor se basa en… dos… proposiciones… debidas a Joule, por un lado, y Carnot y Clausius, por la otra».[16]
Tan pronto como Joule leyó la obra, escribió a Thomson con sus comentarios y preguntas. Así empezó una colaboración fructífera entre ambos hombres, a pesar de que fue esencialmente epistolar, con Joule llevando a cabo experimentos y Thomson analizando los resultados y proponiendo otros nuevos. La colaboración duró de 1852 a 1856, y sus descubrimientos incluyeron el efecto Joule-Thomson, y los resultados publicados contribuyeron mucho a la aceptación general del trabajo de Joule y de la teoría cinética.
Teoría cinética

La cinética es la ciencia que estudia el movimiento.[17][18] Joule fue alumno de Dalton y no es sorpresivo que desarrollara una firme creencia en la teoría atómica, a pesar de que muchos científicos de su época todavía eran escépticos. También fue una de las pocas personas receptivas a la poco aceptada obra de John Herapath sobre la teoría cinética de gases. También fue profundamente influido por la obra de Peter Ewart de 1813 On the measure of moving force.
Joule percibió la relación entre sus descubrimientos y la teoría cinética del calor. Sus notas de laboratorio revelan que creía que el calor era una forma de movimiento más rotacional que translacional.
Joule no pudo resistir encontrar antecedentes de sus creencias en Francis Bacon, Isaac Newton, John Locke, Benjamin Thompson y Humphry Davy. A pesar de que estas creencias están justificadas, Joule calculó un valor para el equivalente mecánico del calor de 1.034 pies-libra a partir de las obras de Thompson. Algunos estudiosos actuales han criticado esto, argumentando que los experimentos de Thompson no representaban medidas cuantitativas sistemáticas. En una de sus notas personales, Joule argumenta que la medida de Mayer no era más precisa que la de Thompson, quizás esperando que Mayer no se hubiera anticipado a su obra.
Muerte y reconocimientos


Joule tenía que haber sido el presidente de la British Association en la reunión de Bradford en 1872 y de nuevo en la reunión de Mánchester de 1887, pero en ambas ocasiones no pudo asistir por cuestiones de salud.[4] A partir de 1872 su salud se debilitó, y desde aquel momento y hasta su muerte el 11 de octubre de 1889 vivió tranquilamente en su residencia del 12 de Wardle Road de Sale,[4][19] donde estudiaba en la medida que su salud se lo permitía. Fue enterrado en el cementerio de Brooklands.[20] La lápida lleva la inscripción «772,75», su medida culminante del equivalente mecánico del calor (1878), y una cita del Evangelio de Juan, «Mientras sea de día, tengo que hacer las obras de quien me ha enviado: pero ahora se acerca la noche, cuando nadie puede trabajar» (Juan, 9:4).[20]
A lo largo de su vida, pero especialmente durante sus últimos años, recibió numerosos reconocimientos provenientes tanto de Inglaterra cómo del extranjero. Joule fue elegido miembro (en inglés, Fellow) de la Royal Society el día 6 de junio de 1850.[4] En 1852 el Consejo de la Royal Society le concedió Joule la Royal Medal por su tarea de investigación;[21] en 1860 le otorgaron la Medalla Copley por los mismos experimentos de la mano de Sir Edward Sabine; en el discurso de entrega Sabine dijo:
El premio de dos medallas por la misma investigación es un procedimiento extremadamente raro en nuestra sociedad, y con razón. En esta ocasión, el Consejo ha deseado mostrar de la manera más enfática posible su opinión del carácter especial y original y la gran utilidad del descubrimiento del Sr. Joule.Sir Edward Sabine (1860)[4]
Varias universidades le concedieron el título de doctor honoris causa; el primero fue el D.C.L. por la Trinity College Dublin (1857), después el D.C.L. por la Universidad de Oxford (1860) y finalmente el D.C.L. por la Universidad de Edimburgo (1871).[4] En 1878 recibió una pensión de £ 200 al año por servicios a la ciencia y el 1880 el príncipe de Gales Eduardo VII le entregó la Albert Medal, otorgada por la Royal Society of Artes.[4] J.P. Joule es miembro honorario de la Institution of Engineers and Shipbuilders in Scotland desde 1857.[22]
Existen dos retratos al óleo de James Prescott; el primero se alberga en una sala de la Manchester Literary and Philosophical Society y fue pintado por George Patten en 1863, mientras que el segundo es propiedad de Royal Society y es obra de George Reynolds en 1882. También Reynolds esculpió un busto en 1882.[4]
En la ciudad de Mánchester cuenta con bastantes reconocimientos, como por ejemplo la biblioteca[23] que lleva su nombre y que, dentro de la Universidad de Mánchester, está especializada en obras de ciencia, tecnología e ingeniería, o como la estatua esculpida por Alfred Gilbert, ubicada justo ante una de Dalton en el exterior del ayuntamiento. En el corazón de la Abadía de Westminster hay un monumento a Joule, a pesar de que no está enterrado allí, contra lo que dicen algunas biografías.[24]
El parque de Worthington, antiguamente parque de Sale, acoge un busto de arcilla bañado en bronce que representa la figura del científico. La obra es de 1905 del escultor John Cassidy. El proyecto fue financiado parcialmente por donaciones, entre otros, de científicos de todo el mundo. El busto presenta Joule sosteniendo una obra científica en la que se entrevé el dibujo de un galvanómetro.[2][25]
El cráter lunar Joule posee ese nombre su honor,[26] así como el submarino francés Joule, que se hundió en los Dardanelos la primavera del 1915.[27]
Actividad cervecera
Junto con su hermano Benjamin, James Joule se hizo cargo de la cervecería situada en Salford que su abuelo William había fundado tres décadas antes de su nacimiento.[28] Mientras que algunos autores afirman que Joule se implicó poco en la gestión de la cervecería, otros dicen todo el contrario, que Joule mostraba un gran interés para mejorar los procesos técnicos, físicos y químicos de la cervecería. Este último punto de vista se sostiene en su correspondencia con Lord Kelvin. La producción de gas durante el proceso de fabricación de la cerveza habría sido el punto de partida para los estudios que desembocaron en el descubrimiento del efecto Joule-Thomson. La enfermedad de su padre y la marcha de su hermano obligaron a James Joule a implicarse con los aspectos técnicos y comerciales de la cervecería. Joule acabó vendiendo la cervecería en 1855, pocos años antes de la muerte de su padre, para centrarse exclusivamente en sus experimentos científicos.[29]
Obra
Joule estudió aspectos relativos al magnetismo, especialmente los relativos a la magnetización del hierro por la acción de corrientes eléctricas, que le llevaron a la invención del motor eléctrico. Descubrió también el fenómeno de magnetostricción, que aparece en los materiales ferromagnéticos, en los que su longitud depende de su estado de magnetización. Pero el área de investigación más fructífera de Joule es la relativa a las distintas formas de energía: con sus experimentos verifica que al fluir una corriente eléctrica a través de un conductor, este experimenta un incremento de temperatura; a partir de ahí dedujo que si la fuente de energía eléctrica es una pila electroquímica, la energía habría de proceder de la transformación llevada a cabo por las reacciones químicas, que la convertirían en energía eléctrica y de esta se transformaría en calor. Si en el circuito se introduce un nuevo elemento, el motor eléctrico, se origina energía mecánica. Ello le lleva a la enunciación del principio de conservación de la energía, y aunque hubo otros físicos de renombre que contribuyeron al establecimiento de este principio como William Thomson (lord Kelvin) y Hermann von Helmholtz, fue Joule quien le proporcionó una mayor solidez.
En 1840 Joule publicó Producción de calor por la electricidad voltaica, en la que estableció la ley que lleva su nombre y que afirma que el calor originado en un conductor por el paso de la corriente eléctrica es proporcional al producto de la resistencia del conductor por el cuadrado de la intensidad de corriente. En 1843, después de numerosos experimentos, obtuvo el valor numérico del equivalente mecánico del calor, que concluyó que era de 4,15 J igual a una caloría (en unidades de hoy), lo que permitía la conversión de las unidades mecánicas y térmicas; este es un valor muy similar al considerado actualmente como de 4,187 J. De ese modo quedaba firmemente establecida la relación entre calor y trabajo, ya avanzada por Thompson, que sirvió de piedra angular para el posterior desarrollo de la termodinámica estadística. En estos trabajos Joule se basaba en la ley de conservación de la energía, descubierta en 1842.
A pesar de que en 1848 ya había publicado un artículo referente a la teoría cinética de los gases, donde por primera vez se estimaba la velocidad de las moléculas gaseosas, abandonó su línea de investigación y prefirió convertirse en ayudante de William Thomson, y, como fruto de esta colaboración, se llegó al descubrimiento del efecto Joule-Thomson, según el cual es posible enfriar un gas en expansión si se lleva a cabo el trabajo necesario para separar las moléculas del gas. Ello posibilitó posteriormente la licuefacción de los gases y llevó a la ley de la energía interna de un gas perfecto, según la cual la energía interna de un gas perfecto es independiente de su volumen y dependiente de la temperatura.
Eponimia
- El julio (adaptación al español de joule), unidad de energía del Sistema Internacional, lleva este nombre en su honor.
- El cráter lunar Joule lleva este nombre en su memoria.
- El asteroide (12759) Joule también conmemora su nombre.
Notas
- ↑ William Robert Grove formuló en 1844 una de las primeras explicaciones generales de la conservación de la energía.
- ↑ La energía requerida para levantar una masa m a una altura h es mgh, donde g es la gravedad estándar. La unidad de Joule es dimensionalmente correcta si se interpreta como fuerza pie-libra. Cuando se utilizan unidades del Sistema Internacional, esta energía se da en términos del epónimo joule: 1 pie-libra = 1,356 J.
Referencias
- ↑ Károly Simonyi (1995). Kulturgeschichte der Physik (en alemán). Frankfurt del Main: Harri Deutsch, Thun. p. 368. ISBN 3-8171-1379-X.
- ↑ a b Hulme, Charles (2010). «James Prescott Joule, Worthington Park, Sale (1905)». John Cassidy 150th Anniversary website (en inglés). Consultado el 29 de mayo de 2013.
- ↑ a b c d e Smith (2004)
- ↑ a b c d e f g h i j Wikitexts: Dictionary of National Biography, Volume 30 Joule, James Prescott , Tetley Glazebrook Richard, en inglés, Varios autores, años 1885-1900, páginas 208-214
- ↑ Joule, James Prescott (1841). On the Heat Evolved by Metallic Conductors of Electricity: And in the Cells of a Battery During Electrolysis (en inglés). Taylor & Francis. p. 20.
- ↑ Smith (1998) p. 60
- ↑ Joule, J.P. (1843). Philosophical Magazine, 23, 263; Scientific Papeles 123
- ↑ Joule, James Prescott. «On the Changes of Temperature Produced by the Rarefaction and Condensation of Air». Philosophical Magazine, Series 3. 26, year = 1845: 369.
- ↑ La unidad de Joule corresponde a 5,3803×10-3 J/caloría. Por lo tanto, la estimación de Joule era de 4,51 J/cal, en comparación al valor aceptado a principios del XX de 4.186 J/cal (M.W. Zemansky (1968) Heat and Thermodynamics, 5th ed., p. 86).
- ↑ Joule, J.P. (1845) «On the rarefaction and condensation of air». Philosophical Magazine, Scientific Papers 172
- ↑ Joule, J.P. (1845) «On the Mechanical Equivalient of Heat» Archivado el 5 de febrero de 2009 en Wayback Machine., Brit. Assoc. Rep., trans. Chemical Sect, p.31, leído en la British Association de Cambridge
- ↑ Joule, J.P (1950) Philosophical Transactions of the Royal Society of London, vol.140, Parte 1, pp61-82
- ↑ Sibum (1994)
- ↑ «Report of the Council, April, 1888, with obituary notices of Charles Moseley and John Benjamin Dancer». Memoirs and Proceedings - Manchester Literary and Philosophical Society (en inglés). Y. Manchester: The Society. 1888. pp. 149?153. Consultado el 28 de junio de 2014.
- ↑ Ver Thomson, William (1848). «On an Absolute Thermometric Scale founded on Carnot's Theory of the Motive Power of Heat, and calculated from Regnault's Observations». Philosophical Journal.- Ver también Thomson, William (1882). Mathematical and Physical Papers. Cambridge, England: Cambridge University Press. pp. 100 - 106.
- ↑ De Boer, R. (2012). Theory of Porous Media: Highlights in Historical Development and Current State (en inglés). Springer Science & Business Media. p. 177. ISBN 9783642596377.
- ↑ Britannica Online Dictionary
- ↑ Louis Adolphe Martin (1907). Text-book of Mechanics (en inglés). Wiley. pp. Section X, pág. 69ff.
- ↑ GRO Register of Deaths: DEC 1889 8a 121 ALTRINCHAM - James Prescott Joule
- ↑ a b Peter J Whitehead. James Prescott Joule, the man pittdixon.go-plus.net
- ↑ Wikitexts: Popular Science Monthly Volume 5 May 1874 en inglés, Varios autores, páginas 102-106
- ↑ «IESIS. Honorary Members and Fellows». iesis.org (en inglés).
- ↑ The University of Manchester Library, ed. (2013). «Joule Library home page» (en inglés). Manchester. Consultado el 29 de mayo de 2013.
- ↑ Reynolds, Osborne (2011). Memoir of James Prescott Joule. (en inglés). Cambridge University Press. pp. pág. 169. ISBN 9781108028806. Consultado el 28 de mayo de 2013.
- ↑ johncassidy.org.uk (ed.). «James Prescott Joule, Worthington Park, Salo (1905)» (en inglés).
- ↑ Entrada en la International Astronomical Union (IAU) Working Group for Planetary System Nomenclature (WGPSN)
- ↑ Cardwell, D. L. S. (= 1989). James Joule: A Biography (en inglés). Manchester University Press. p. 267. ISBN 9780719034794.
- ↑ Joule's Story (en inglés)
- ↑ Alan Gall: James Joule – Brewer and Man of Science, Brew. Hist., 115, pág. 2-6 (en línea)
Bibliografía
 Varios autores (1910-1911). «Joule, James Prescott». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Joule, James Prescott». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público. «Joule, James Prescott». Dictionary of National Biography (en inglés). Londres: Smith, Elder & Co. 1885–1900. OCLC 2763972.
«Joule, James Prescott». Dictionary of National Biography (en inglés). Londres: Smith, Elder & Co. 1885–1900. OCLC 2763972.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre James Prescott Joule.
Wikimedia Commons alberga una categoría multimedia sobre James Prescott Joule. Wikiquote alberga frases célebres de o sobre James Prescott Joule.
Wikiquote alberga frases célebres de o sobre James Prescott Joule.- Documentos clásicos del 1845 y del 1847 en el web de ChemTeam Archivado el 5 de febrero de 2009 en Wayback Machine. On the Mechanical Equivalent of Heat y On the Existence of an Equivalent Relation between Heat and the ordinary Forms of Mechanical Power






